


NO1 激光在美國的管制情況
FDA是美國食品藥品監督管理局的簡稱,監管美國食品、醫療、激光、化妝品產品在美國銷售的許可和監督。凡是含有激光的產品出口到美國,因為其存在激光輻射隱患,均受FDA管制,由CDRH部門負責具體監管和準入事宜。比如激光醫療器械、激光美容儀、激光機械、消費類激光產品、激光玩具、工礦用激光、激光舞臺、激光測量探測等等均為管制對象。

NO2 FDA認證流程
2.1關于檢測
2.1.1 檢測確認:
a,提供產品規格書,確認檢測費用;
b,確認費用,雙方簽合同;
c,郵寄樣品,開始安排測試;d,出具檢測報告草稿,確認信息;
e,報告確認OK,出報告正式蓋章檔。
注:
1,咨詢費用時,需要提供激光產品規格書、電路圖、產品圖片等資料;
2,檢測周期一般1-2周,需要根據具體產品而定,整改周期不算在內;
2.1.2 測試標準
FDA激光可以直接使用21CFR 1040.10+21CFR 1040.11(指示器、舞臺燈、醫療激光適用)或, IEC 60825-1+Laser Notice 56.
2.1.3
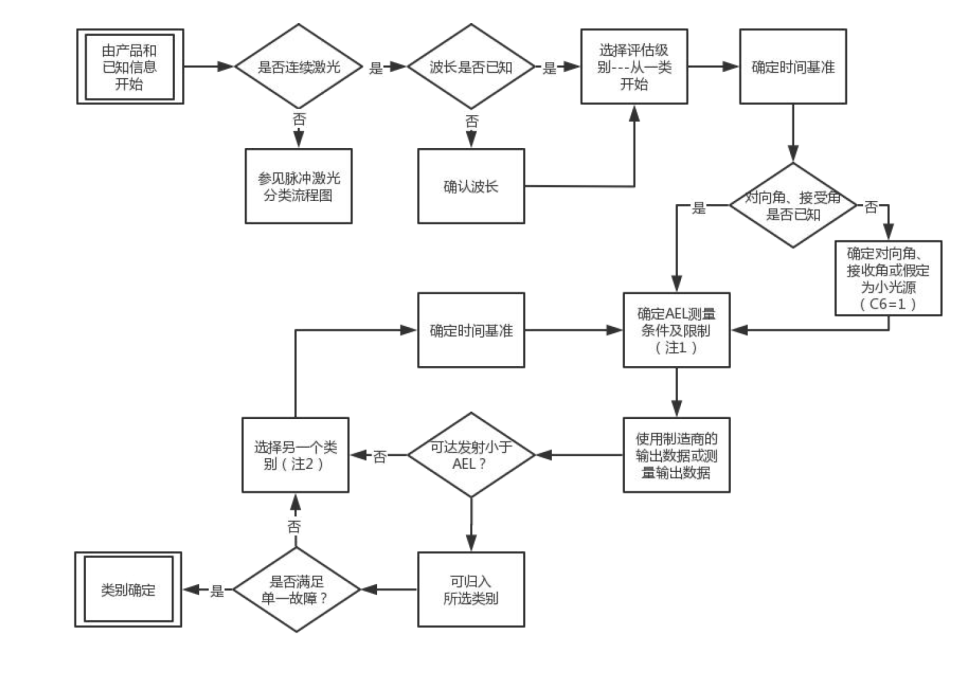
連續激光測試流程如下
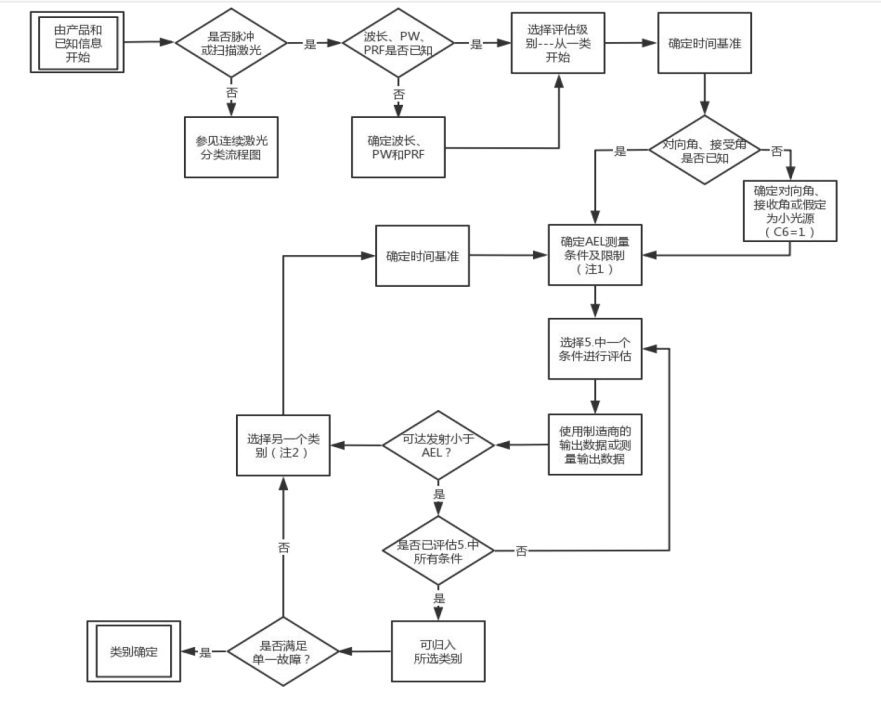
脈沖激光測試流程如下
2.1.3 激光標記
21 CFR 1040.10激光標簽如下
等級 | 標簽 |
Class I | 無要求 |
Class IIa (標識文字即可) | Class IIa Laser Product - Avoid Long-Term Viewing of Direct Laser Radiation. |
Class II |
|
Class IIIa (<2.5mw/cm2 用黃色) (>2.5mw/cm2 用紅色) |
|
Class IIIb |
|
Class IV |
|
IEC 60825-1激光標簽如下
等級 | 標簽 |
Class 1 |
|
Class 1M |
|
Class 1C |
|
Class 2 |
|
Class 2M |
|
Class 3R |
|
Class 3B |
|
Class 4 |
|
2.1.4 認證標記
測試合格后,需要在產品上貼認證標記(此處認證標簽更多是聲明的意思,而不是認證機構頒發的認證標志),如下
直接使用21CFR 1040.10+21CFR 1040.11進行測試的 | 使用IEC 60825-1+Notice 56進行測試的 |
Complies with 21 CFR 1040.10 and 1040.11 | Complies with FDA performance standards for laser products except for conformance with IEC 60825-1 Ed. 3., as described in Laser Notice No. 56, dated May 8, 2019. |
另,均需增加制造商名稱、地址和生產日期 | |

2.2 關于注冊:
注冊為常規大眾接受的稱謂,FDA稱之為報告。
依據規則分為:
首次報告:21 CFR 1002.10
補充報告:21CFR 1002.11(如適用)
簡化報告:21CFR 1002.12(部分產品適用)
年度報告:21CFR 1002.13(每年9.1至10.1間進行)
意外輻射事故報告:21CFR 1002.20(如有發生)
檢測合格后進行首次報告,完成后獲得FDA檔案回執(含Accession Number)。
報告資料含量大部分
第一部分,產品技術資料,包括但不限于:激光檢測報告、產品規格書、電路圖、光路圖、結構圖、產品銘牌、激光標簽、認證標簽、產品標識照等
第二部分,生產過程質量保證資料,包括但不限于:出廠QC檢驗報告(含激光功率監控和其他關鍵項目)、測試儀器校準報告、壽命及可靠性測試方案和記錄、生產流程關鍵步驟、關鍵器件清單和質量保證程序、美國代理人協議、產品質量聲明等。
同時,制造商還應依據21CFR 1002.30做好生產制造記錄,依據21CFR 1002.31做好產品檢查測試記錄。
NO3 關于產品出口

--FDA注冊后,是沒有證書的,FDA官方是不會出任何證書;如果有證書,均是第三方服務機構自己出的,與FDA無關;
--FDA logo 不允許運用到任何報告或證書上,也不允許打印到產品或外包裝上;但是注冊號碼可以打印到產品和包裝上;
--FDA注冊后,次年開始的每一年都需要進行年報(如上21CFR 1002.13);
--FDA注冊,以制造商公司為主體的進行注冊。
--進口激光產品到美國時,進口商需要宣告進口的電子產品需要符合美國法規要求。即需要填報FORM FDA 2877表。內容要素有:進口港口、進口編號、制造商名稱地址和原產國、進口商的名稱地址、產品描述(名稱)、產品數量、型號和商標、及注冊是獲得的Accession Number。
--特別警告:
根據《美國法典》第18編第1001條,任何人故意作出虛假申報,可被處以不超過10000美元的罰款或不超過5年的監禁,或兩者并罰。
任何人進口不符合要求的電子產品也可能會受到1000美元-300000美元的罰款。

返回頂部